BAB I
PENDAHULUAN
1.1 Latar
Belakang
Struktur atom
merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron
bermuatan negatif yang mengelilinginya. Inti atom mengandung campuran proton
yang bermuatan positif dan neutron yang bermuatan netral (terkecuali pada
Hidrogen-1 yang tidak memiliki neutron). Elektron-elektron pada sebuah atom
terikat pada inti atom oleh gaya elektromagnetik. Demikian pula sekumpulan atom
dapat berikatan satu sama lainnya membentuk sebuah molekul. Atom yang
mengandung jumlah proton dan elektron yang sama bersifat netral sedangkan yang mengandung jumlah
proton dan elektron yang berbeda bersifat positif atau negatif dan merupakan
ion. Atom dikelompokkan berdasarkan jumlah proton dan
neutron pada inti atom tersebut. Jumlah proton pada atom
menentukan unsur kimia atom tersebut
dan
jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa Yunani
yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi
lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali
diajukan oleh para filsuf India
dan Yunani.
Pada abad ke-17 dan ke-18 para
kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat
tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode
kimia. Selama akhir abad ke-19 dan awal abad ke-20 para fisikawan berhasil
menemukan struktur dan komponen-komponen sub
atom
di dalam atom membuktikan
bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum
yang digunakan para fisikawan kemudian berhasil memodelkan atom.
Relatif terhadap pengamatan sehari-hari
atom merupakan objek yang sangat kecil dengan massa yang sama kecilnya pula. Atom
hanya dapat dipantau menggunakan peralatan khusus seperti mikroskop
penerowongan payaran. Lebih dari 99,9% massa atom berpusat pada inti atom
dengan proton dan neutron yang bermassa hampir sama.
Setiap unsur paling tidak memiliki satu
isotop dengan inti yang tidak stabil yang dapat mengalami peluruhan radioaktif. Hal ini dapat
mengakibatkan transmutasi yang mengubah jumlah proton dan neutron pada inti.
Elektron yang terikat pada atom mengandung sejumlah aras energi ataupun orbital yang stabil dan dapat mengalami
transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang
sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat
kimiawi sebuah unsur dan memengaruhi sifat-sifat magnetis atom tersebut.
Pada tahun 1913 Neils Bohr pertama kali
mengajukan teori kuantum untuk atom hydrogen. Model ini merupakan transisi
antara model mekanika klasik dan mekanika gelombang karena pada prinsip fisika klasik
tidak sesuai dengan kemantapan hidrogen atom yang teramati. Model atom
Bohr memperbaiki kelemahan model atom Rutherford. Untuk menutupi kelemahan
model atom Rutherford, Bohr mengeluarkan empat postulat. Gagasan Bohr menyatakan
bahwa elektron harus mengorbit di sekeliling inti. Namun demikian teori atom
yang dikemukakan oleh Neils Bohr juga memiliki banyak kelemahan. Model Bohr
hanyalah bermanfaat untuk atom-atom yang mengandung satu elektron tetapi tidak
untuk atom yang berelektron banyak.
1.2 Tujuan
Makalah
Adapun tujuan yang ingin dicapai dalam pembuatan makalah ini adalah
:
- Untuk membandingkan model atom Thomsom,Rutherford,dan John Dalton dengan model atom Niels Bohr.
- Untuk mengetahui karakteristik atau perbedaan dari model atom Niels Bohr dengan model atom yang lainnya.
- Untuk mengetahui postulat yang dikemukakan Niels Bohr untuk membuat model atom Niels Bohr.
1.3 Manfaat
Makalah
Manfaat yang diharapkan dari hasil
penelitian ini adalah :
- Dapat membandingkan model atom Thomsom,Rutherford,dan John Dalton dengan model atom Niels Bohr.
- Dapat mengetahui karakteristik atau perbedaan dari model atom Niels Bohr dengan model atom yang lainnya.
- Dapat mengetahui postulat yang dikemukakan Niels Bohr untuk membuat model atom Niels Bohr.
BAB
II
LANDASAN
TEORI
Pengertian
Model Atom
Atom merupakan satuan dasar materi yang
terdiri dari inti atom beserta awan elektron bermuatan negatif yang
mengelilinginya. Inti atom mengandung campuran proton yang bermuatan positif
dan neutron yang bermuatan netral.
Pada
tahun 1913
pakar fisika Denmark Niels Bohr menyatakan bahwa kegagalan model atom
Rutherford dapat disempurnakan dengan menerapkan Teori Kuantum dari Planck.
Model atom Bohr dinyatakan dalam bentuk empat postulat berkaitan dengan
pergerakan elektron yaitu
sebagai berikut :
- Dalam mengelilingi inti atom, elektron berada pada kulit (lintasan) tertentu. Kulit ini merupakan gerakan stasioner (menetap) dari elektron dalam mengelilingi inti atom dengan jarak tertentu.
- Selama elektron berada pada lintasan stasioner tertentu, energi elektron tetap sehingga tidak ada energi yang diemisikan atau diserap.
- Elektron dapat beralih dari satu kulit ke kulit lain. Pada peralihan ini, besarnya energi yang terlibat sama dengan persamaan Planck, ΔE = h.
- Lintasan stasioner elektron memiliki momentum sudut. Besarnya momentum sudut adalah kelipatan dari nh/2π , dengan n adalah bilangan kuantum dan h adalah tetapan Planck.
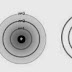
Gambar
1 : Model
atom Bohr menyempurnakan model atom Rutherford dalam hal kedudukan elektron di
sekeliling inti atom.
Sejarah
Penemuan
Di awal abad ke-20 percobaan oleh Ernest Rutherford
telah dapat menunjukkan bahwa atom terdiri dari sebentuk awan difus elektron
bermuatan negatif mengelilingi inti yang kecil padat dan bermuatan positif. Berdasarkan
data percobaan ini sangat wajar jika fisikawan kemudian membayangkan sebuah
model sistem keplanetan yang diterapkan pada atom model Rutherford tahun 1911
dengan elektron-elektron mengorbit inti seperti layaknya planet mengorbit
matahari. Namun demikian model
sistem keplanetan untuk atom menemui beberapa kesulitan. Sebagai contoh hukum
mekanika klasik (Newtonian) memprediksi bahwa elektron akan melepas radiasi
elektromagnetik ketika sedang mengorbit inti karena dalam pelepasan tersebut
elektron kehilangan energi maka lama-kelamaan
akan jatuh secara spiral menuju ke inti.
Ketika ini terjadi frekuensi radiasi
elektromagnetik yang dipancarkan akan berubah. Namun
percobaan pada akhir abad 19 menunjukkan bahwa loncatan bunga api listrik yang
dilalukan dalam suatu gas bertekanan rendah di dalam sebuah tabung hampa akan
membuat atom atom gas memancarkan cahaya (yang berarti radiasi elektromagnetik)
dalam frekuensi-frekuensi tetap yang diskret.
Pada tahun 1913 Niels Bohr fisikawan
berkebangsaan Swedia mengikuti jejak Einstein menerapkan teori kuantum untuk
menerangkan hasil studinya mengenai spektrum atom hidrogen. Bohr mengemukakan
teori baru mengenai struktur dan sifat-sifat atom. Teori atom Bohr ini pada
prinsipnya menggabungkan teori kuantum Planck dan teori atom dari Ernest
Rutherford yang dikemukakan pada tahun 1911. Bohr mengemukakan bahwa apabila
elektron dalam orbit atom menyerap suatu kuantum energi elektron akan meloncat keluar
menuju orbit yang lebih tinggi. Sebaliknya, jika elektron itu memancarkan suatu
kuantum energi elektron akan jatuh ke orbit yang lebih dekat dengan inti atom.
Untuk
mengatasi hal ini dan kesulitan-kesulitan lainnya dalam menjelaskan gerak
elektron di dalam atom pada tahun 1913
Niels Bohr mengusulkan dua gagasan kunci model
atom Niels Bohr yaitu :
- Elektron-elektron bergerak di dalam orbit-orbit dan memiliki momenta yang terkuantisasi dan dengan demikian energi yang terkuantisasi. Ini berarti tidak setiap orbit melainkan hanya beberapa orbit spesifik yang dimungkinkan ada yang berada pada jarak yang spesifik dari inti.
- Elektron-elektron tidak akan kehilangan energi secara perlahan-lahan sebagaimana mereka bergerak di dalam orbit melainkan akan tetap stabil di dalam sebuah orbit yang tidak meluruh.
Arti
penting model ini terletak pada pernyataan bahwa hukum mekanika klasik tidak
berlaku pada gerak elektron di sekitar inti. Bohr mengusulkan bahwa satu
bentuk mekanika baru atau
mekanika kuantum
menggambarkan gerak elektron di
sekitar inti. Namun demikian model elektron yang bergerak dalam orbit yang
terkuantisasi mengelilingi inti ini kemudian digantikan oleh model gerak
elektron yang lebih akurat sekitar sepuluh tahun kemudian oleh fisikawan
Austria Erwin Schrödinger dan fisikawan Jerman Werner Heisenberg. Point-point
penting lainnya adalah:
- Ketika sebuah elektron meloncat dari satu orbit ke orbit lainnya, perbedaan energi dibawa (atau dipasok) oleh sebuah kuantum tunggal cahaya (disebut sebagai foton) yang memiliki energi sama dengan perbedaan energi antara kedua orbit.
- Orbit-orbit yang diperkenankan bergantung pada harga-harga terkuantisasi (diskret) dari momentum sudut orbital, L menurut persamaan
Point (2) menyatakan bahwa harga
terendah dari n adalah 1. Ini berhubungan dengan radius terkecil yang
mungkin yaitu 0.0529 nm. Radius ini dikenal sebagai radius
Bohr. Sekali elektron berada pada orbit
ini, dia tidak akan mungkin bertambah lebih dekat lagi ke proton.
Teori
Model Atom Niels Bohr
Model atom hidrogen Bohr dapat
menjelaskan spektrum gas hidrogen yang ditemukan dari percobaan. Misalnya
pemancaran sinar merah oleh gas hidrogen terjadi ketika elektron berpindah dari
kulit ketiga (n=3) ke kulit kedua (n=2).
Gambar 2
Model atom Hidrogen menurut Niels Bohr
Meskipun model atom Bohr dapat menjelaskan spektrum hidrogen dan
spektrum dari spesi lain berelektron tunggal tetapi model tersebut tidak dapat
menjelaskan spektrum dari atom yang lebih kompleks. Oleh karena itu para ahli
tetap berupaya mencari penjelasan yang lebih sempurna. Ide penting yang sangat
berharga dari teori Bohr adalah gagasab tentang tingkat energi dalam atom yaitu
gagasan tentang kulit-kulit atom.
Untuk menentukan konfigurasi elektron suatu unsur, ada
beberapa patokan yang harus selalu diingat, yaitu:
- Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan disebut kulit ke-1 (kulit k kulit ke-2 (kulit L), kulit ke-3 (kulit M), kulit ke-4 (kulit N), dan seterusnya.
- Jumlah elektron maksimum (paling banyak) yang
dapat menempati masing-masing kulit adala
·
Kulit K dapat menampung
maksimal 2 elektron.
·
Kulit L dapat menampung
maksimal 8 elektron.
·
Kulit M dapat menampung
maksimal 18 elektron, dan seterusnya.
3. Kulit yang paling luar hanya boleh mengandung
maksimal 8 elektron.
|
Bilangan kuantum (n)
|
1
|
2
|
3
|
4
|
Dan seterusnya
|
|
Lambing kulit
|
K
|
L
|
M
|
N
|
Dan seterusnya
|
Kulit atau lintasan elektron dalam mengelilingi inti atom
dilambangkan dengan n = 1, n = 2, n = 3, dan seterusnya.
Lambang ini dinamakan bilangan kuantum. Model atom Bohr ditunjukkan pada
Gambar 1 huruf K, L, M,
dan seterusnya digunakan untuk menyatakan lintasan elektron dalam mengelilingi
inti atom. Lintasan dengan n = 1 disebut kulit K, lintasan dengan n =
2 disebut kulit L, dan seterusnya.
Semakin besar harga n (makin jauh dari inti), makin besar energi
elektron yang mengorbit pada kulit itu. Jadi tingkat energi kulit L lebih besar
daripada kulit K,tingkat energi kulit M lebih besar daripada kulit L dan
seterusnya. Kulit yang ditempati electron apakah kulit K,L,M atau yang lainnya
bergantung pada energi elektron itu.
Dalam penjelasannya bohr, menggunakan atom hidogen sebagai model.
Bohr berhasil merumuskan jari-jari lintasan dan energi electron pada tom
hydrogen sebagai berikut :
- Lintasan yang diizinkan untuk elektron dinomori n = 1, n = 2, n =3 dst. Bilangan ini dinamakan bilangan kuantum, huruf K, L, M, N juga digunakan untuk menamakan lintasan.
- Jari-jari orbit diungkapkan dengan 12, 22, 32, 42, …n2. Untuk orbit tertentu dengan jari-jari minimum a0 = 0,53 Å.
- Jika elektron tertarik ke inti dan dimiliki oleh orbit n, energi dipancarkan dan energi elektron menjadi lebih rendah sebesar.
”Bohr menyatakan bahwa
elektron-elektron hanya menempati orbit-orbit tertentu disekitar inti atom,
yang masing-masing terkait sejumlah energi kelipatan dari suatu nilai kuantum
dasar. (John Gribbin, 2002)” Model Bohr dari atom hidrogen menggambarkan
elektron-elektron bermuatan negatif mengorbit pada kulit atom dalam lintasan
tertentu mengelilingi inti atom yang bermuatan positif.
Ketika elektron meloncat dari satu
orbit ke orbit lainnya selalu disertai dengan pemancaran atau penyerapan
sejumlah energi elektromagnetik hf.Menurut Bohr : ” Ada aturan fisika
kuantum yang hanya mengizinkan sejumlah tertentu elektron dalam tiap orbit. Hanya
ada ruang untuk dua elektron dalam orbit terdekat dari inti. (John Gribbin,
2005)”.
Bohr juga menyatakan bahwa electron
menggelilingi inti pada orbit tertentu. Di dalam atom terdapat orbit luar dan
orbit dalam. Orbit dalam adalah orbit electron didekat inti Orbit luar dapat
menampung lebih banyak electron. Elektron pada orbit luar menentukan
sifat-sifat kimia atom.Kadang-kadang electron pada orbit luar melompat ke orbit
dalam. Pada waktu melompat electron itu mengeluarkan cahaya.
Teori Bohr memperkenalkan perbedaan radikal
dengan gagasan teori klasik fisika. Beberapa ilmuwan yang penuh imajinasi
(seperti Einstein) segera bergegas memuji kertas kerja Bohr sebagai suatu
“masterpiece,” suatu kerja besar; meski begitu, banyak ilmuwan lainnya pada
mulanya menganggap sepi kebenaran teori baru ini.
Percobaan
Niels Bohr
Percobaan yang paling kritis adalah
kemampuan teori Bohr menjelaskan spektrum dari hydrogen atom. Telah lama
diketahui bahwa gas hydrogen jika dipanaskan pada tingkat kepanasan tinggi,
akan mengeluarkan cahaya. Tetapi, cahaya ini tidaklah mencakup semua warna,
tetapi hanya cahaya dari sesuatu frekuensi tertentu. Nilai terbesar dari teori
Bohr tentang atom adalah berangkat dari hipotesa sederhana tetapi sanggup
menjelaskan dengan ketetapan yang mengagumkan tentang gelombang panjang yang
persis dari semua garis spektral (warna) yang dikeluarkan oleh hidrogen.
Lebih jauh dari itu, teori Bohr
memperkirakan adanya garis spektral tambahan, tidak terlihat pada saat
sebelumnya, tetapi kemudian dipastikan oleh para pencoba. Sebagai tambahan,
teori Bohr tentang struktur atom menyuguhkan penjelasan pertama yang jelas apa
sebab atom punya ukuran seperti adanya. Tetapi sementara itu teori struktur
atom Bohr menghadapi kesulitan-kesulitan.
Masalah terpokok adalah bahwa teori Bohr
meskipun dengan sempurna menjelaskan kesulitan masa depan atom (misalnya
hidrogen) yang punya satu elektron tidak dengan persis memperkirakan spektra
dari atom-atom lain. Beberapa ilmuwan terpukau oleh sukses luar biasa teori
Bohr dalam hal memaparkan atom hidrogen, berharap dengan jalan menyempurnakan
sedikit teori Bohr mereka dapat juga menjelaskan spektra atom yang lebih berat.
Bohr sendiri merupakan salah seorang pertama yang menyadari penyempurnaan kecil
itu tak akan menolong karena itu yang diperlukan adalah perombakan radikal.
Tetapi bagaimanapun dia mengerahkan segenap akal geniusnya tetapi dia tidak
mampu memecahkannya.
Pemecahan akhirnya ditemukan oleh
Werner Heisenberg dan lain-lainnya, mulai tahun 1925 yang menarik untuk dicatat
di sini bahwa Heisenberg dan umumnya ilmuwan yang mengembangkan teori baru
belajar di Kopenhagen, yang tidak diduga lagi telah mengambil manfaat yang
besar dari diskusi-diskusi dengan Bohr dan saling berhubungan satu sama lain.
Bohr sendiri bergegas menuju ide baru itu dan membantu mengembangkannya. Dia
membuat sumbangan penting terhadap teori baru, dan liwat disuksi-diskusi dan
tulisan-tulisan, dia menolong membikin lebih sistematis.
Niels Henrik David Bohr yang lahir 7 Oktober 1885 di Kopenhagen. Beliau meninggal pada 8
November 1962 pada umur 77 tahun. Dia meraih gelar doktor fisika dari
Universitas Copenhagen pada 1911. Sesudah dia pergi ke Cambridge Inggris,
disana dia belajar di bawah asuhan J.J. Thompson ilmuwan kenamaan yang
menemukan elektron. Hanya dalam beberapa bulan sesudah itu Bohr pindah lagi ke
Manchester belajar pada Ernest Rutherford yang beberapa tahun sebelumnya
menemukan nucleus (bagian inti) atom. Rutherford
menegaskan (berbeda dengan pendapat-pendapat sebelumnya) bahwa atom umumnya
kosong dengan bagian pokok yang berat pada tengahnya dan elektron di bagian
luarnya. Kemudian Bohr segera mengembangkan teorinya sendiri yang baru serta
radikal tentang struktur atom.Teori Bohr memperkenalkan atom sebagai sejenis
miniatur planet mengitari matahari dengan elektron-elektron mengelilingi
orbitnya sekitar bagian pokok tetapi dengan perbedaan yang sangat penting:
bilamana hukum-hukum fisika klasik mengatakan tentang perputaran orbit dalam
segala ukuran,
Bohr membuktikan bahwa elektron-elektron dalam
sebuah atom hanya dapat berputar dalam orbitnya dalam ukuran spesifik tertentu,
atau dalam kalimat rumusan lain: elektron-elektron yang mengitari bagian pokok
berada pada tingkat energi (kulit) tertentu tanpa menyerap atau memancarkan
energi. Elektron dapat berpindah dari lapisan dalam ke lapisan luar jika
menyerap energi. Sebaliknya, elektron akan berpindah dari lapisan luar ke
lapisan lebih dalam dengan memancarkan energi.
Ditilik dari semua kejadian yang meyakinkan
ini, teori Bohr segera diterima, dan di tahun 1922 Bohr dapat,hadiah Nobel
untuk bidang fisika.Tahun 1920 lembaga Fisika Teoritis didirikan di Kopenhagen
dan Bohr jadi direkturnya. Di bawah pirnpinannya cepat menarik minat
ilmuwan-ilmuwan muda yang brilian dan segera menjadi pusat penyelidikan ilmiah
dunia.
Tahun 1930-an lebih menunjukkan
perhatiannya terhadap permasalahan bagian pokok struktur atom. Dia
mengembangkan model penting “tetesan cairan” bagian pokok atom. Dia juga
mengajukan masalah teori tentang “kombinasi bagian pokok” dalam reaksi atom untuk
dipecahkan. Tambahan pula Bohr merupakan orang yang dengan cepat menyatakan
bahwa isotop uranium yang terlibat dalam pembagian nuklir adalah U235.
Pernyataan ini punya makna penting dalam pengembangan berikutnya dari bom atom.
Dalam tahun 1940 balatentara Jerman menduduki Denmark. Ini menempatkan
diri Bohr dalam bahaya sebagian karena dia punya sikap anti Nazi sudah tersebar
luas, sebagian karena ibunya seorang Yahudi.
Tahun 1943 Bohr lari meninggalkan Denmark yang jadi daerah pendudukan, menuju
Swedia. Dia juga menolong sejumlah besar orang Yahudi Denmark melarikan diri
agar terhindar dari kematian dalam kamar-kamar gas Hitler.
Dari Swedia Bohr lari ke Inggris dan dari sana menyeberang ke
Amerika Serikat. Di negeri ini, selama perang berlangsung, Bohr membantu
membikin bom atom,Seusai perang, Bohr kembali kampung ke Denmark dan mengepalai
lembaga hingga rohnya melayang tahun 1562.
Dalam tahun-tahun sesudah perang Bohr berusaha keras walau tak
berhasil mendorong dunia internasional agar mengawasi penggunaan energi
atom.Bohr menikah pada tahun 1912, di sekitar saat-saat dia melakukan kerja
besar di bidang ilmu pengetahuan. Dia punya lima anak, salah seorang bernama
Aage Bohr, memenangkan hadiah Nobel untuk bidang fisika di tahun 1975. Bohr
merupakan orang yang paling disenangi di dunia ilmuwan, bukan semata-mata
karena menghormat ilmunya yang genius, tetapi juga pribadinya dan karakter
serta rasa kemanusiaannya yang mendalam. Kendati teori orisinal Bohr tentang
struktur atom sudah berlalu lima puluh tahun yang lampau, dia tetap merupakan
salah satu dari tokoh besar di abad ke-20.
Ada beberapa alasan mengapa begitu. Pertama, sebagian dari hal-hal
penting teorinya masih tetap dianggap benar. Misalnya, gagasannya bahwa atom
dapat ada hanya pada tingkat energi yang cermat adalah merupakan bagian tak
terpisahkan dari semua teori-teori struktur atom berikutnya. Hal lainnya lagi,
gambaran Bohr tentang atom punya arti besar buat menemukan sesuatu untuk diri
sendiri, meskipun ilmuwan modern tak menganggap hal itu secara harfiah benar.
Yang paling penting dari semuanya itu, mungkin, adalah gagasan Bohr yang
merupakan tenaga pendorong bagi perkembangan “teori kuantum.” Meskipun beberapa
gagasannya telah kedaluwarsa, namun jelas secara historis teori-teorinya sudah
membuktikan merupakan titik tolak teori modern tentang atom dan perkembangan
berikutnya bidang mekanika kuantum.
BAB III
PEMBAHASAN
Ringkasan
Teori
Model Bohr hanya akurat untuk sistem
satu elektron seperti atom hidrogen
atau helium
yang terionisasi satu kali. Bagian ini hendak menurunkan rumusan
tingkat-tingkat energi atom hidrogen menggunakan model Bohr.Penurunan rumus
didasarkan pada tiga asumsi sederhana:
- Energi sebuah elektron dalam orbit
adalah penjumlahan energi kinetik dan energi potensialnya:
- Momentum sudut elektron hanya boleh memiliki harga
diskret tertentu:
dengan n = 1,2,3,… dan disebut bilangan kuantum utama, h adalah konstanta Planck, dan
- Elektron berada dalam orbit diatur oleh gaya coulomb. Ini
berarti gaya coulomb sama dengan gaya sentripetal:
4. Suku di sisi kiri menyatakan energi potensial,
sehingga persamaan untuk energi menjadi:
5. Dengan menyelesaikan persamaan (2) untuk r,
didapatkan harga jari-jari yang diperkenankan:
Dengan memasukkan persamaan (6) ke persamaan (4),
maka diperoleh:
Dengan membagi kedua sisi persamaan (7) dengan mev
didapatkan
6. Dengan memasukkan harga v pada persamaan
energi (persamaan (5)), dan kemudian mensubstitusikan harga untuk k dan  maka energi pada tingkatan orbit yang berbeda
dari atom hidrogen dapat ditentukan sebagai berikut:
maka energi pada tingkatan orbit yang berbeda
dari atom hidrogen dapat ditentukan sebagai berikut:
 maka energi pada tingkatan orbit yang berbeda
dari atom hidrogen dapat ditentukan sebagai berikut:
maka energi pada tingkatan orbit yang berbeda
dari atom hidrogen dapat ditentukan sebagai berikut:
Dengan memasukkan harga semua konstanta,
didapatkan,
Dengan demikian, tingkat energi
terendah untuk atom hidrogen (n = 1) adalah -13.6 eV. Tingkat energi berikutnya (n = 2) adalah -3.4 eV.
Tingkat energi ketiga (n = 3) adalah -1.51 eV, dan seterusnya.
Harga-harga
energi ini adalah negatif, yang menyatakan bahwa elektron berada dalam keadaan
terikat dengan proton. Harga energi yang positif berhubungan dengan atom yang
berada dalam keadaan terionisasi yaitu ketika elektron tidak lagi terikat, tetapi dalam
keadaan tersebar.
Postulat
Model Atom Niels Bohr
Ada empat postulat yang digunakan
untuk menutupi kelemahan model atom Rutherford, antara lain :
- Atom Hidrogen terdiri dari sebuah elektron yang bergerak dalam suatu lintas edar berbentuk lingkaran mengelilingi inti atom ; gerak elektron tersebut dipengaruhi oleh gaya coulomb sesuai dengan kaidah mekanika klasik.
- Lintas edar elektron dalam hydrogen yang mantap hanyalah memiliki harga momentum angular L yang merupakan kelipatan dari tetapan Planck dibagi dengan 2π. dimana n = 1,2,3,… dan disebut sebagai bilangan kuantum utama, dan h adalah konstanta Planck.
- Dalam lintas edar yang mantap elektron yang mengelilingi inti atom tidak memancarkan energi elektromagnetik, dalam hal ini energi totalnya E tidak berubah.
- Jika suatu atom melakukan transisi dari keadaan energi tinggi EU ke keadaan energi lebih rendah EI, sebuah foton dengan energi hυ=EU-EI diemisikan. Jika sebuah foton diserap, atom tersebut akan bertransisi ke keadaan energi rendah ke keadaan energi tinggi.
Kelebihan
dan Kekurangan
Adapun kelebihan dari Model
Atom Niels Bohr adalah sebagai berikut :
- Atom terdiri dari beberapa kulit/subkulit untuk tempat berpindahnya electron dan atom membentuk suatu orbit dimana inti atom merupakan positif dan disekelilingnya terdapat elektron.
- Mampu membuktikan adanya lintasan elektron untuk atom hidrogen dengan jari-jari bola:= 0,529 Angstrom= 0,529 x 10–10m= 1 bohr.
- Bohr-sommerfeld mengembangkan orbit Bohr (bola) menjadi orbital yaitu fungsi gelombang elektron atau identitas elektron sebagai gelombang yang memiliki bentuk bola (l = 0, orbital s) atau 1 bola, (l = 1, orbital p) atau 2 balon terpilin, (l = 2, orbital d) atau 3 balon terpilin, (l = 3, orbital f).
- Elektron tidak mengorbit mengelilingi inti melalui sembarang lintasan, tp hanya melalui lintasan tertentu dengan momentum sudut tertentu tanpa melepaskan energi (= Lintasan Stasioner )
- Elektron dapat berpindah hanya dengan melepaskan dan menyerap energi sebesar hf (energi foton)
Adapun Kekurangan dari Model Atom Niels Bohr
adalah sebagai berikut :
- Hanya dapat menerangkan spektrum dari atom atau ion yang mengandung satu elektron dan tidak sesuai dengan spektrum atom atau ion yang berelektron banyak.
- Tidak mampu menerangkan bahwa atom dapat membentuk molekul melalui ikatan kimia
- Tidak dapat menjelaskan efek Zeeman dan efek Strack.
- Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron lebih banyak.
- Menurutnya kedudukan dalam mengelilingi atom dinyatakan dengan pasti.
- Gerakan elektron digambarkan sebagai lingkaran/elip.
- Tidak dapat menerangkan intensitas spektrum lebih lanjut
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
- Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang.
(((( JIKA ADA YANG SALAH MOHON MASUKANNYA,, TERIMAKASIH))))













0 komentar on Model atom niels bohr :
Post a Comment and Don't Spam!